元紀事
國內首個真實世界證據支持藥物研發與審評的指導文件發布
文件旨在厘清藥物研發和監管決策中真實世界證據的相關定義,指導真實世界數據收集以及適用性評估,明確真實世界證據在藥物監管決策中的地位和適用范圍,探究真實世界證據的評價原則,為工業界和監管部門利用真實世界證據支持藥物監管決策提供參考意見。

業界和學界都對其評價頗高。有學者認為這是一個里程碑式的事件,因為它是從監管理念上的極大的轉變,真實世界研究適應了當前科學發展的方向,將會是藥品研發的一個重要方向。
早在去年5月征求意見稿發布時,在醫藥界已經引起很大的震動。新藥研發耗時長、成本高,從而造成患者負擔重,這是世界難題,在降低藥物研發成本方面,真實世界研究可謂是為數不多的創新方向之一。
藥企非常歡迎真實世界證據,一家跨國藥企的管理人員認為,之前已有很多藥品通過真實世界數據獲批新適應證,以前可能是實在沒有辦法的情況下,會考慮真實世界數據,有了政策之后,會更方便,或更早期去討論使用真實世界證據。

《原則》明確,真實世界證據是指通過對適用的真實世界數據進行恰當和充分的分析所獲得的關于藥物的使用情況和潛在獲益-風險的臨床證據,包括通過對回顧性或前瞻性觀察性研究或者實用臨床試驗等干預性研究獲得的證據。
真實世界數據的常見來源包括但不限于:衛生信息系統(HospitalInformation System,HIS),醫保系統,疾病登記系統,國家藥品不良反應監測哨點聯盟,自然人群隊列和專病隊列數據庫,組學相關數據庫,死亡登記數據庫,患者報告結局數據,來自移動設備端的數據等。
2016年12月美國通過的《21世紀治愈法案》,通常被視為真實世界證據支持藥物和其他醫療產品的監管決策、加快醫藥產品研發的起點。在這之后,RWS已成為全球相關監管機構、制藥工業界和學術界共同關注且極具挑戰性的問題。
國家藥監局此次《指導原則》的發布,僅僅比美國晚了3年,我國在新藥審評審批上的創新越來越快了。
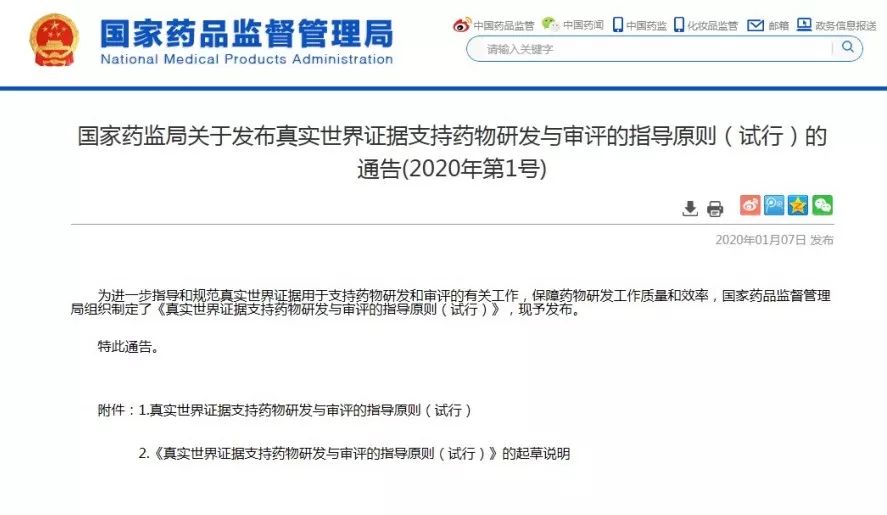
《原則》指出,真實世界研究是指針對預設的臨床問題,在真實世界環境下收集與研究對象健康有關的數據(真實世界數據)或基于這些數據衍生的匯總數據,通過分析,獲得藥物的使用情況及潛在獲益-風險的臨床證據(真實世界證據)的研究過程(如圖1所示)。

圖1支持藥物監管決策的真實世界研究路徑(實線所示)
真實世界證據支持藥物監管決策的主要應用范圍
真實世界證據應用于支持藥物監管決策,涵蓋上市前臨床研發以及上市后再評價等多個環節。例如,為新產品批準上市提供有效性或安全性的證據;為已獲批產品修改說明書提供證據,包括增加或修改適應證,改變劑量、給藥方案或給藥途徑,增加新適用人群,增加實效比較信息,增加安全性信息等;作為上市后要求的一部分支持監管決策的證據等。
罕見病藥物準入、廣譜藥物(例如PD-1抑制劑)新適應證審批、中醫藥再評價,被認為是最快能從《指導原則》中獲益的方向。
真實世界證據支持藥物監管決策的主要應用范圍有:
1.為新藥注冊上市提供有效性和安全性的證據
中國有2000萬左右罕見患者。2018年5月,國家發布《第一批罕見病目錄》,納入121種罕見病,大約影響300萬名患者。截至2018年12月,其中74種在美國或歐盟、日本等地有162種治療藥品。當中只有83種在中國上市,可治療53種罕見病。
每一種罕見病藥物,幾乎就代表了一個群體的生存希望。但有一半國外已獲批的罕見病藥物未能進入中國,很重要的原因就在于臨床試驗很難完成。
傳統的臨床試驗需要一個實驗組和一個對照組,罕見病人本來就很稀少,想要招募到足夠的病人入組就成了最大的挑戰。
但如果能用真實世界數據來展示疾病的自然特征,將它和實驗組進行對比,就可以少招募一半的病人,這無疑會大大減輕藥企的成本,加快罕見病新藥在國內的注冊上市。
另外,對適應證很廣譜的藥物,比如像PD-1抑制劑,新藥上市之后,通常有很多超適應證用藥的情況,怎么去迅速擴展更多適應證,真實世界研究是非常好的一種方法。
2.為已上市藥物的說明書變更提供證據
對于已經上市的藥物,新增適應證通常情況下需要RCT支持。但當RCT不可行或非最優的研究設計時,采用PCT或觀察性研究等生成的真實世界證據支持新增適應癥可能更具可行性和合理性。
增加或者修改適應證;改變劑量、給藥方案或者用藥途徑;增加新的適用人群;添加實效比較研究的結果;增加安全性信息;說明書的其他修改。
3.為藥物上市后要求或再評價提供證據
基于RCT證據獲批的藥物,通常由于病例數較少、研究時間較短、試驗對象入組條件嚴格、干預標準化等原因,存在安全性信息有限、療效結論外推不確定、用藥方案未必最優、經濟學效益缺乏等不足,需要利用真實世界數據對藥物在真實醫療實踐中的效果、安全性、使用情況,以及經濟學效益等方面進行更全面的評估,并不斷根據真實世界證據做出決策調整。
4.名老中醫經驗方、中藥醫療機構制劑的人用經驗總結與臨床研發
對于名老中醫經驗方、中藥醫療機構制劑等已有人用經驗藥物的臨床研發,在處方固定、生產工藝路線基本成型的基礎上,可嘗試將真實世界研究與隨機臨床試驗相結合,探索臨床研發的新路徑。
5.真實世界證據用于監管決策的其他應用,包括指導臨床研究設計和精準定位目標人群等。
真實世界研究的意義和價值
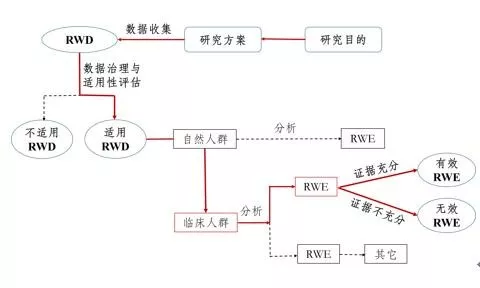
相對于傳統的藥物臨床試驗的隨機對照試驗(RandomizedControlled Trial,RCT)方法,在評價藥物安全性和有效性時常常會帶來時間久、成本高的代價,如業內共識一款新藥平均研發10年、成本10億美金的說法,最近幾年,這個成本還在上升。
而真實世界研究,不僅可以利用真實世界數據支持審評,可以部分取代目前藥物研發中的臨床試驗,節省藥物研發成本。
此外,真實世界數據有些是前瞻性的,也有一些是回顧性的,基于歷史數據進行注冊審批,還能縮減藥品審批上市的時間,因此受到藥企歡迎。

RCT與RWE對比(來源:《真實世界研究指南2018版》)
基于此,《原則》中也列舉了兩項真實世界證據的研究案例:
示例1:利用真實世界證據支持新增適應證
申辦方在某藥上市后發起一項通過真實世界數據評價其在中國女性中減少臨床骨質疏松性骨折的有效性和安全性研究。
該研究遵循真實世界研究的良好實踐,研究方案事先公開。真實世界數據來源具有良好的研究人群代表性,樣本量達4萬余人。
該研究的主要終點通過病歷審查進行驗證,以傾向評分匹配作為主要分析方法,同時使用逆概率加權法、高維傾向評分調整等多種方法進行敏感性分析,并定量評估未測量到的混雜因素的影響。
該真實世界研究的結果與全球RCT研究相近,并用不同數據來源、不同研究機構的真實世界數據重現出該結果。

示例2:利用真實世界證據支持擴大聯合用藥

真實世界中患者所聯合的化療方案并不局限于卡鉑與紫杉醇,還包括培美曲塞聯合鉑類、吉西他濱聯合順鉑等。2018年10月該藥獲批將治療方案擴展為聯合以鉑類為基礎的化療方案,其中三項真實世界研究結果提供了強有力的支持證據。
這三項研究回顧性分析了山東省腫瘤醫院、江蘇省腫瘤醫院和中國醫學科學院腫瘤醫院三家醫院的真實世界患者數據,均顯示在含鉑雙藥化療基礎上聯合貝伐珠單抗較單純化療顯著延長PFS和OS,與全球人群數據具有一致性,并且未發現新的安全性問題。
此外,相關真實世界研究還提供了EGFR突變和腦轉移等不同患者亞組中的療效數據,從多角度證實了貝伐珠單抗聯合療法的有效性和安全性。
真實世界數據指導細則正在研討推進
真實世界證據對藥物研發來說,最直接的價值就是降低成本。新藥研發時間長、成本高、成功率低,多年前就有一款新藥平均研發10年、成本10億美金的說法,最近幾年成本還在上升。

這也是藥企歡迎真實世界證據的原因之一,前述跨國藥企的管理人員說,對于新藥研發,真實世界證據可以在一定程度上減少Ⅲ期臨床試驗的成本;對于擴適應證的藥品,可以直接免去Ⅲ期臨床試驗。

有專業人士認為,對于符合真實世界證據要求的企業來講,它的成本和時間將會急劇的降低,尤其是廣譜藥拓適應證,用真實世界證據非常好,不過隨機對照臨床試驗還會是新藥上市的主流,真實世界證據作為輔助和補充。
在政策初期,藥企如果可以負擔隨機對照臨床研究,可能還是會優先選擇隨機對照臨床研究,畢竟真實世界證據還需要不斷進一步驗證。政策實施之后,會有很多的企業會去嘗試發起真實世界研究,但最終能真正有效可靠的證據不會太多,這是因為作為真實世界研究前提的真實世界數據基礎還不夠。

真實世界研究,有些是前瞻性的,也有一些是回顧性的,基于歷史數據進行注冊審批。基于歷史數據的研究并不完全取決于企業本身是否有能力,更重要的是目前數據的可獲得性,以及它們的質量能否滿足注冊的需要。
過去,醫療系統內的數據本就不是為了注冊需要,主要是出于監管的需要,比如醫保系統首要是為了滿足醫保作為支付監管的任務,但真實世界研究需要注冊申請、評估效果、說明產品有效性、安全性的數據,原有系統的數據豐富程度還不夠。
不過,《指導原則》中大篇幅地提出了對于真實世界數據的表述,包括數據相關性和可靠性的評估以及統計方法和研究方法的介紹,說明監管部門在政策的制定上非常落地。
如果說《指導原則》的出臺是為真實世界證據的應用確立了規范,那么接下來政策的順利落地還將需要更多的細則和標準。據了解,關于真實世界數據的指導細則也研討推進中,規定什么樣的真實世界數據可以獲得真實世界證據,進而拓展適應證。





